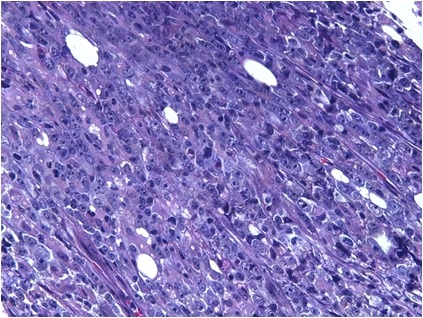
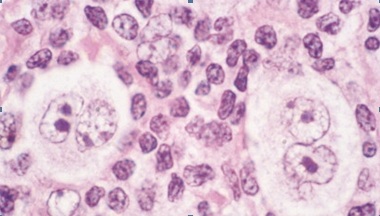
Il mieloma multiplo (MM) è una neoplasia maligna caratterizzata dalla proliferazione di un clone di plasmacellule, ovvero linfociti B al termine del loro processo maturativo, nel midollo osseo e, nelle fasi più avanzate della malattia, in sedi extramidollari. Le caratteristiche cliniche derivano dagli effetti dell’infiltrazione da parte delle plasmacellule neoplastiche in diversi organi, ed in particolare a livello osteomidollare, e dalla produzione di immunoglobuline (che determinano la “componente monoclonale”) caratterizzate da proprietà fisico-chimiche anomale. Fisiologicamente, infatti, le plasmacellule producono un’ampia gamma di immunoglobuline (anticorpi) finalizzate alla protezione contro le infezioni da agenti patogeni.
Generalmente il MM è preceduto da una condizione pre-neoplastica definita gammopatia monoclonale di incerto significato (MGUS) – presente nel 3% della popolazione con età superiore ai 50 anni – caratterizzata da un rischio di progressione a MM pari all’ 1% l’anno. In alcuni pazienti è possibile inoltre riconoscere la forma asintomatica di MM, detta anche mieloma smoldering, che presenta un rischio di progressione a MM sintomatico superiore, attestandosi al 10-20% l’anno. In queste forme e nelle fasi iniziali di MM sintomatico, il clone neoplastico prolifera nel midollo osseo, mentre negli stadi più avanzati di malattia le plasmacellule maligne possono interessare diverse sedi extramidollari come il sangue (in tal caso si parla di leucemia plasmacellulare) o le cavità corporee (pleure,peritoneo).
Epidemiologia
Tale neoplasia rappresenta circa lo 0,8 % di tutti i tumori e il 10 % di quelli ematologici, con un tasso di incidenza pari a 4,5 e 3,2 casi annui ogni 100.000 abitanti, rispettivamente nella popolazione maschile e femminile italiana. Ciò si traduce in circa 3.400 nuovi casi/anno, con una mortalità pari a circa 2.500 morti/anno. L’incidenza del MM aumenta all’aumentare dell’età: la mediana dell’età alla presentazione è circa 70 anni; meno del 15% dei pazienti ha meno di 60 anni.
Eziologia
L’eziologia del MM rimane in larga parte sconosciuta. Tuttavia, si considerano fattori di rischio per lo sviluppo di tale patologia l’esposizione a radiazioni ionizzanti e sostanze chimiche (quali vernici, gomme, pesticidi); la stimolazione antigenica ripetuta, determinata da agenti virali quali HHV8, HIV o HCV; infine, la presenza di una malattia autoimmune. Inoltre, sembrano essere implicati fattori genetici, come dimostrato dalla maggiore incidenza della malattia nella popolazione afro-americana e dal riscontro di alcune forme familiari.
Manifestazioni cliniche
La clinica del MM è caratterizzata da:
- Lesioni osteolitiche, osteoporosi o fratture patologiche, che si riscontrano circa nel 80% dei pazienti alla diagnosi. Tali lesioni si manifestano con dolore osseo, spesso severo e aggravato dai movimenti, presente nel 60% dei casi. Una grave complicanza di tali lesioni e rappresentata dal crollo vertebrale, che può causare la compressione delle radici o del midollo spinale, portando in alcuni casi alla paraplegia.
- Anemia: generalmente normocitica normocromica, presente inizialmente in circa il 70% dei pazienti.
- Ipercalcemia: dovuta all’aumentato rimaneggiamento osseo, presente raramente nelle prime fasi della malattia ma più frequentemente negli stadi più avanzati.
- Insufficienza renale: insorge in circa il 50% dei pazienti durante la progressione della malattia. Vari fattori vi concorrono, soprattutto la precipitazione della componente monoclonale (definita proteinuria di Bence Jones) nei tubuli distali e nei dotti collettori e l’ipercalcemia.
- Infezioni ricorrenti: tipicamente da batteri capsulati e causata da un deficit dell’immunità umorale e cellulare.
- Sindrome da iperviscosità: poco frequente, complica generalmente i MM secernenti IgA ed e caratterizzata da disturbi visivi, neurologici, emorragie mucose e manifestazioni cardiovascolari.
Diagnosi e stadiazione
Spesso la diagnosi di MM segue il riscontro occasionale un picco monoclonale all’elettroforesi delle proteine sieriche; in alcuni casi, al contrario, sono i sintomi clinici (come, ad esempio, le algie ossee) che spingono all’esecuzione di esami di approfondimento.
Gli esami ematochimici essenziali sono i seguenti:
- Esame emocromocitometrico;
- valutazione della funzionalità renale ed epatica, albumina, beta2-microglobulina e ionemia (in particolare la calcemia)
- Elettroforesi ed immunofissazione sierica, dosaggio della componente monoclonale e delle immunoglobuline;
- Dosaggio delle Free Light Chains (FLC);
- Proteinuria delle 24 ore, immunofissazione urinaria e dosaggio delle catene leggere urinarie (Proteinuria di bence Jones).
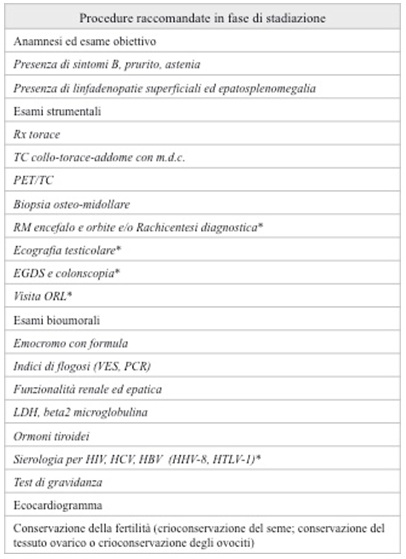
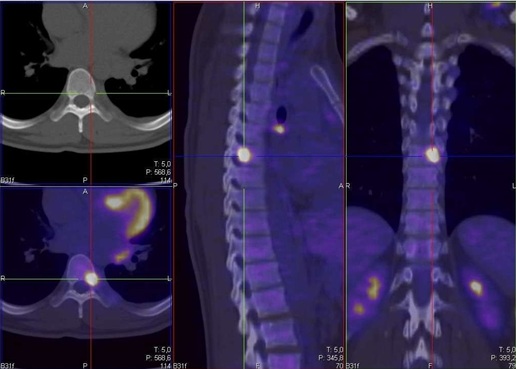
E’ necessario inoltre sottoporre il paziente ad aspirato e biopsia osteomidollare, oltre che ad uno skeletal survey, caratterizzato dall’esecuzione di una radiografia dello scheletro in toto ed ev., in casi selezionati, Risonanza magnetica (full spine o whole body) e/o PET/TC.
Come precedentemente descritto e secondo i criteri del International Myeloma Working Group (IMWG) del 2003, si definiscono:
- MGUS (monoclonal gammopathy of undetermined significance – gammopatia monoclonale di incerto significato) la presenza di una componente monoclonale < 30 g/L e di una quota di plasmacelule all’esame midollare < 10% in assenza di segni di danno d’organo (ovvero: anemia, ipercalcemia, insufficienza renale, lesioni ossee);
- MM smoldering (asintomatico) viene definito dalla presenza di una componente monoclonale sierica ≥ 30 g/L e/o una quota plasmacellulare all’esame midollare ≥ 10%, in assenza di segni di danno d’organo.
- MM sintomatico: presenza di almeno un segno di danno d’organo, indipendentemente dall’entità della componente monoclonale e dall’infiltrato di plasmacelule midollare.
I sistemi di stadiazione attualmente in uso per il MM sono 2: il sistema di stadiazione secondo Durie&Salmon e quello secondo ISS (International Staging System) (tabella 1).

Terapia
A tutt’oggi il MM è una malattia incurabile e la terapia viene riservata ai casi sintomatici secondo i cosiddetti criteri CRAB (ipercalcemia [C], insufficienza renale [R], anemia [A], lesioni ossee litiche [B]). Gli scopi del trattamento sono il controllo della malattia, il miglioramento della qualità di vita e, infine, il prolungamento della sopravvivenza. Accanto alla terapia con farmaci citotossici, la terapia di supporto, che consiste nella terapia delle manifestazioni cliniche (anemia, ipercalcemia, insufficienza renale, dolore secondario alla presenza di lesioni ossee, infezioni, iperviscosità), svolge un ruolo cruciale. In particolare, il controllo del dolore (presente soprattutto in caso di localizzazioni alla colonna vertebrale) può richiedere un approccio multidisciplinare (farmacologico, radioterapico, ortopedico, neurochirurgico).
Negli ultimi anni, grazie all’introduzione di nuovi farmaci, le opzioni terapeutiche per il MM sono molteplici. Generalmente si distinguono due approcci terapeutici in base all’età del paziente (non necessariamente anagrafica).
Pazienti giovani, ovvero candidabili a terapia ad alte dosi e trapianto di midollo autologo.
L’introduzione dei nuovi farmaci, quali la talidomide, la lenalidomide e il bortezomib, generalmente in associazione allo steroide, ha permesso di aumentare il tasso di risposta, la sopravvivenza libera da malattia e la sopravvivenza globale dei pazienti affetti da MM, soppiantando definitivamente lo schema VAD (Vincristina, Doxorubicina, Desametasone), come dimostrato da numerosi studi pubblicati o in fase di pubblicazione. La scelta del farmaco ottimale viene effettuata in base del profilo di tossicità e alle comorbidità del paziente.
In seguito alla terapia di induzione, i pazienti sono sottoposti ad una chemioterapia di mobilizzazione con Ciclofosfamide a dosi intermedie o alte, in associazione a fattori di crescita granulocitari, per permettere la mobilizzazione delle cellule staminali ematopoietiche nel sangue periferico e, quindi, la loro raccolta mediante la procedura di staminoaferesi. Successivamente i pazienti vengono avviati ad alla chemioterapia di condizionamento, che prevede l’utilizzo del Melphalan ad alte dosi, seguito dalla reinfusione delle cellule staminali autologhe. In casi selezionati è possibile procedere ad un secondo trapianto autologo. Non è ancora stato chiarito il ruolo di una terapia di consolidamento e di mantenimento dopo l’autotrapianto.
Il trapianto allogenico da donatore, nonostante sia l’unico trattamento potenzialmente in grado di eradicare la malattia, è riservato ai pazienti giovani < 50 anni a prognosi particolarmente sfavorevole, in quanto è gravato da una elevata mortalità legata alla procedura.
Pazienti anziani, ovvero non candidabili a terapia ad alte dosi e trapianto di midollo autologo.
L’introduzione dei nuovi farmaci ha permesso di ottenere dei buoni risultati in termini di sopravvivenza anche nei pazienti anziani o non candidabili ad una terapia intensiva. Alla terapia con Melphalan e Prednisone (MP), introdotta dai primi anni ‘60, è attualmente possibile associare la talidomide (MPT), il bortezomib (VMP) o la lenalidomide (MPR), ottenendo dei tassi di risposta maggiori e un prolungamento della sopravvivenza libera da malattia rispetto al classico MP.
Protocolli attivi
Il nostro Centro è il coordinatore del Registro Triveneto Mieloma, in collaborazione con il reparto di Ematologia & Centro Trapianti di midollo osseo di Bolzano, che mira a definire e classificare in maniera prospettica, dal punto di vista epidemiologico e clinico i pazienti con mieloma multiplo nel territorio del Triveneto. Il principale obiettivo è quindi la creazione di un database informatico che consenta la registrazione e l’analisi dei dati di ogni singolo paziente in maniera omogenea e standardizzata.
Presso la nostra struttura sono attivi i seguenti protocolli sperimentali:
- EMN01: studio multicentrico, randomizzato, controllato, di fase III a tre bracci paralleli per determinare l’efficacia e la sicurezza di lenalidomide in combinazione con desametasone (Rd) versus lenalidomide, melphalan e prednisone (MPR) versus lenalidomide, ciclofosfamide e prednisone (CPR) in pazienti anziani (età ≥ 65 anni) con nuova diagnosi di mieloma multiplo.
- HO95_EMN02: Studio di fase III, randomizzato, per confrontare Bortezomib, Melphalan, Prednisone (VMP) con Melphalan ad alte dosi seguito da Bortezomib, Lenalidomide, Desametasone (VRD) come consolidamento e Lenalidomide in mantenimento in pazienti con nuova diagnosi di mieloma multiplo (età 18-65 anni).
- 26866138MMY2069: studio multicentrico di fase II di velcade (bortezomib) sottocute più melphalan e prednisone orale o più ciclofosfamide e prednisone o più prednisone in pazienti anziani con nuova diagnosi di mieloma multiplo (età ≥ 75 anni o < 75 anni con anomalie cardiache, polmonari, renali o epatiche (non candidabili per protocolli con criteri di inclusione/esclusione standard).
- ZMP-1: studio di fase I/II, multicentrico, in aperto con vorinostat in associazione con melphalan e prednisone (ZMP) in pazienti con mieloma multiplo avanzato o refrattario (età ≥ 18 anni)
- MM-003: studio di fase III, multicentrico, randomizzato, in aperto, per confrontare l’efficacia e la tollerabilità della Pomalidomide in combinazione con basse dosi di desametasone versus alte dosi di desametsone in pazieni con mieloma multiplo refrattario o recidivato (età ≥ 18 anni)
- BDT-01-2011: studio multicentrico di fase II per valutare l’efficacia e la sicurezza di bendamustina, desametasone e talidomide in pazienti con mieloma multiplo ricaduti o refrattari dopo un trattamento con lenalidomide e bortezomib o ineleggibili alla terapia con tali farmaci (età ≥ 18 anni).
- MM-Rel: studio di fase III di confronto tra bortezomib, ciclofosfamide e desametasone rispetto a lenalidomide, ciclofosfamide e desametasone in pazienti con mieloma multiplo in prima ricaduta (età 18-75 anni).
- CC-5013-PASS-001: studio osservazionale sulla sicurezza della terapia con lenalidomide.
- PD-CPN1: Studio osservazione sulla neuropatia indotta dalla chemioterapia nei pazienti affetti da mieloma multiplo e in terapia con lenalidomide.