I linfomi non Hodgkin (LNH) sono nel loro complesso la neoplasia ematologica più frequente e costituiscono il 3% di tutti i tumori maligni e il 70% di tutti i linfomi. In base ai dati dell’AIRTUM (Associazione Italiana Registri Tumori) nel periodo 1998-2002 i LNH hanno causato il 2,8% del totale dei decessi tumorali fra gli uomini e il 3,6% fra le donne. L’incidenza dei LNH varia secondo il tipo istologico e dell’area geografica, tuttavia essa appare in continua crescita e aumenta all’aumentare dell’età, anche se alcuni LNH aggressivi tendono a interessare i soggetti giovani – adulti (30-40 anni).
Eziologia
I fattori causali di questa malattia non sono ancora ben noti. Esistono, come nel linfoma di Hodgkin, dei fattori predisponenti, a seconda del sottotipo istologico di linfoma, quali agenti infettivi come il virus di Epstein-Barr (EBV, lo stesso agente causale della mononucleosi), l’herpes virus umano HHV-8, il retrovirus HTLV-1 (Human T-lymphotropic virus 1 o Virus T-linfotropico dell’uomo), il virus dell’epatite C (HCV), il batterio Helicobacter pylori; condizioni di disregolazione del sistema immunitario, come la presenza di malattie autoimmuni (ad esempio malattia celiaca o le tireopatie), stati di immunodeficienza (inclusa la sindrome di immunodeficienza acquisita – AIDS – causata dal virus HIV) e di immunosoppressione (post-trapianto d’organo); l’esposizione ad alcune sostanze tossiche.
Caratteristiche istologiche
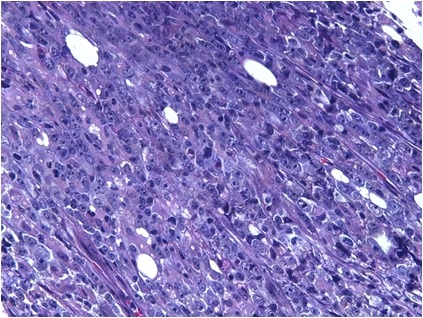
Le cellule neoplastiche dei LNH derivano da linfociti e possono esprimere il fenotipo di membrana di tipo B (più frequentemente), di tipo T o NK. Secondo la classificazione WHO (World Health Organization) del 2008 si contano oltre 60 entità clinico-patologiche, classificate, per quanto possibile, in base alla corrispondente controparte normale: si distinguono pertanto le forme che derivano dai precursori B e T linfocitari e forme che originano da linfociti maturi, con caratteristiche istologiche, biologiche e cliniche molto diverse tra loro. In base all’andamento clinico i LNH possono essere ulteriormente distinti in “aggressivi” o “ad alto grado di malignità” (Figura 1), caratterizzati da una maggiore aggressività che richiede un trattamento tempestivo, e “indolenti” o a “basso grado di malignità” ma con minori possibilità di guarigione definitiva.
Manifestazioni cliniche
Nella maggioranza dei pazienti l’esordio di un LNH è caratterizzato dalla comparsa di una tumefazione in sede linfonodale superficiale senza sintomi d’accompagnamento. Nel 30% dei casi è presente una localizzazione in sede extra-nodale (ovvero in qualsiasi organo non linfoide), in particolare il midollo osseo, la cute, il tratto gastro-intestinale, il testicolo, il fegato, il sistema nervoso centrale, l’apparato scheletrico, il miocardio e pericardio, il polmone e la pleura. In alcuni tipi di linfoma (come il linfoma primitivo del mediastino) si riscontra il coinvolgimento dei linfonodi del mediastino come unica sede di malattia, con la presenza di una massa bulky (ovvero maggiore di un terzo del diametro toracico) (Figura 2).
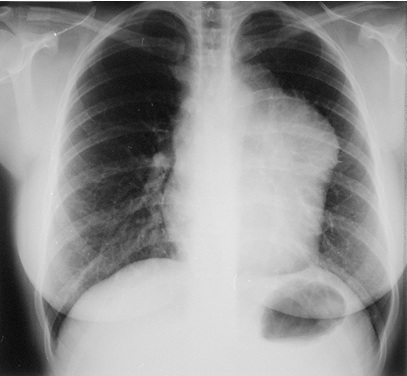
Il mediastino è lo spazio toracico compreso tra le due cavità pleuriche ed è delimitato anteriormente dallo sterno, posteriormente dalla colonna vertebrale, lateralmente dalle pleure mediastiniche, superiormente comunica direttamente con le fasce cervicali attraverso uno spazio definito “stretto toracico superiore” ed inferiormente è delimitato dal diaframma. La presenza di una massa mediastinica può determinare sintomi compressivi, compromettendo le vie aeree, quali tosse stizzosa, dolore toracico, dispnea (“fame d’aria”), o sintomi correlati alla compressione dei vasi, ovvero la sindrome della vena cava superiore, caratterizzata da congestione ed edema dei tessuti del capo, del collo, della parte superiore del torace e degli arti superiori (edema a mantellina), spesso associata a trombosi venosa.
La maggior parte dei pazienti affetti da linfomi indolenti è asintomatico, tuttavia, soprattutto in caso di masse bulky (ovvero una massa linfonodale di dimensioni superiori ai 10 cm o, come detto, allargamento mediastinico maggiore di un terzo del diametro toracico) possono concomitare sintomi sistemici definiti “sintomi B”, quali febbre intermittente, sudorazioni profuse, soprattutto notturne e perdita di peso (non secondaria a diete). Tali sintomi sono più frequenti nelle forme più aggressive.
Diagnosi, stadiazione e definizione dei fattori prognostici
Per la diagnosi iniziale di LNH è essenziale eseguire una biopsia escissionale di un linfonodo o di una sede extra-linfonodale sospetti per localizzazione di malattia.
Per “stadiazione” si intende la valutazione dell’estensione della malattia. Le metodiche strumentali utilizzate sono la radiografia del torace, la TC del collo-torace-addome (tomografia computerizzata) con mezzo di contrasto, la PET/TC (tomografia ad emissione di positroni combinata con la TC) e la biopsia osteomidollare. Altre indagini che vengono eseguite in casi selezionati sono: risonanza magnetica (RM) di encefalo/orbite e/o rachicentesi (puntura lombare) nel caso vi sia il rischio o il sospetto di localizzazioni al sistema nervoso centrale (SNC); ecografia testicolare; esofago-gastro-duodenoscopia (EGDS) e colonscopia, nel caso vi sia il rischio o il sospetto di localizzazioni a livello del tratto gastro-intestinale; visita otorinolaringoiatrica con laringoscopia, nel caso di sospetta localizzazione nel cosiddetto “anello del Waldeyer”, ovvero il tessuto linfatico associato alle vie aero-digestive, che comprende tonsille palatine, il tessuto linfatico del rinofaringe e della base della lingua. Queste indagini permettono di definire lo stadio della malattia, come nel linfoma di Hodgkin, secondo il sistema di stadiazione di Ann Arbor, che prevede uno STADIO I in caso di interessamento di un solo linfonodo o di una sola stazione linfonodale; uno STADIO II in caso di interessamento di due o più stazioni linfonodali, tutte al di sopra o sotto il diaframma; STADIO III in caso di interessamento di stazioni linfonodali sia sopra che sotto il diaframma; STADIO IV in caso di interessamento di strutture extra-linfatiche (Figura 3).
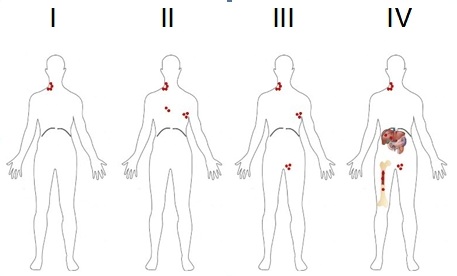
In base alla presenza dei sintomi B lo stadio viene ulteriormente distinto in A (assenza dei sintomi) o B (presenza dei sintomi). Il termine Bulky viene usato per identificare una massa tumorale di grandi dimensioni (come definito sopra). Alla diagnosi vengono inoltre eseguite altre indagini volte a indagare la funzionalità d’organo, quali esami ematochimici e sierologici (emocromo con formula, funzionalità epatica e renale, ormoni tiroidei, indici di flogosi quali VES e PCR, profilo proteico, LDH e b2microglobulina, test di gravidanza nelle donne in età fertile); elettrocardiogramma ed ecocardiogramma. Prima di iniziare la chemioterapia, se le condizioni cliniche lo permettono, viene offerta la possibilità di eseguire la conservazione della fertilità (crioconservazione del seme; conservazione del tessuto ovarico o crioconservazione degli ovociti) (Tabella 1).
(*in casi selezionati).
I principali fattori prognostici negativi per i LNH aggressivi sono l’età maggiore di 60 anni, il performance status, ovvero la valutazione delle capacità quotidiane e lavorative, lo stadio della malattia all’esordio, il numero di sedi extranodali interessate, il valore di LDH, la presenza di sintomi sistemici. Altri fattori prognostici sono la leucocitosi per il linfoma mantellare e il numero di sedi nodali e la presenza di anemia per il linfoma follicolare.
Terapia
I LNH sono patologie chemio e radiosensibili, per questo, le strategie terapeutiche prevedono l’utilizzo della chemioterapia, della radioterapia e, più recentemente, dell’immunoterapia (mediante l’utilizzo di anticorpi monoclonali).
Nei LNH di tipo B ad andamento aggressivo l’approccio è generalmente combinato, ovvero caratterizzato dall’utilizzo di schemi di immuno-polichemioterapia, tra cui il più comunemente utilizzato è lo schema R-CHOP, costituito dall’anticorpo monoclonale anti-CD20 (un marcatore di superficie espresso dalle cellule B neoplastiche e dai linfociti B normali) Rituximab, associato ad altri 4 farmaci (Ciclofosfamide, Adriamicina, Vincristina e Prednisone) che vengono somministrati tramite infusione endovenosa (in una vena periferica o, preferibilmente, in una vena centrale tramite l’inserzione di un catetere venoso). Ciascun ciclo viene somministrato ogni 21 giorni (R-CHOP-21); in casi selezionati esso può essere somministrato ogni 14 giorni (R-CHOP-14). Il numero di cicli e l’eventuale radioterapia sulle sedi coinvolte (involved-field) dipende dallo stadio della malattia alla diagnosi e dai fattori di rischio presenti: nei casi più favorevoli è possibile un programma di chemioterapia abbreviato, costituito da 3-4 cicli secondo schema R-CHOP, seguiti da radioterapia, fino ai 6-8 cicli degli stadi avanzati. Gli effetti collaterali del trattamento più frequenti sono la nausea ed il vomito; l’effetto tossico sul midollo osseo, che si manifesta con una riduzione dei globuli bianchi (in particolare dei neutrofili); l’alopecia (ovvero la caduta dei capelli e dei peli) per l’effetto sui bulbi piliferi ed, infine, la spossatezza. Altri effetti di più rara insorgenza sono la comparsa di formicolii alle dita delle mani e dei piedi (segno di neurotossicità dovuta alla vincristina), la cardiotossicità (dovuta all’adriamicina) che può portare a gravi quadri di cardiomiopatia fino allo scompenso cardiaco. Una complicanza della Ciclofosfamide, che generalmente avviene a dosaggi maggiori rispetto a quelli previsti nello schema R-CHOP, è la cistite emorragica, per cui si raccomanda ai pazienti di assumere un’adeguata quantità di liquidi durante il trattamento. Gli effetti collaterali del Rituximab sono per lo più secondari a reazioni allergiche (brivido, rialzo febbrile, soprattutto alle prime somministrazioni, nei casi più gravi broncospasmo e angioedema) e all’immunosoppressione. Per ridurre la frequenza e l’entità delle reazioni allergiche, il farmaco viene premedicato con cortisone, paracetamolo e antistaminici e somministrare il farmaco in infusione lenta.
In caso di manifestazioni in sedi extranodali particolari, quali testicolo, seni paranasali, palato, orbite, masse paravertebrali e midollo osseo, in considerazione dell’elevato rischio di recidiva a livello del SNC, è indicata l’esecuzione di rachicentesi medicate, ovvero l’infusione di sostanze chemioterapiche nel canale vertebrale.
Circa il 50% dei pazienti con linfoma non Hodgkin B diffuso a grandi cellule (che rappresenta circa il 40% dei linfomi diagnosticati nei Paesi occidentali) non ottengono la remissione con la terapia di prima linea o manifestano una recidiva dopo il raggiungimento della remissione. La chemioterapia di salvataggio utilizzata nei pazienti giovani consiste negli schemi R-DHAP (Rituximab, Cisplatino, Citarabina ad alte dosi, Desametasone) o R-IEV (Rituximab, Ifosfamide, Etoposide, Epirubicina) con raccolta delle cellule staminali e successivo trapianto autologo. Per i pazienti che presentano una ricaduta di malattia dopo trapianto autologo di cellule staminali ematopoietiche un’alternativa è rappresentata dal trapianto allogenico (da donatore familiare o da registro). Nel caso di pazienti anziani che, pertanto, non sono candidati alla procedura trapiantologica, possono essere utilizzati programmi di polichemioterapia di salvataggio o terapia con nuovi farmaci, come la Lenalidomide.
Alcuni linfomi, come il linfoma primitivo del mediastino, il linfoma di Burkitt o il linfoma mantellare, richiedono un approccio terapeutico più intensivo, con schemi di chemioterapia intensificata ed eventuale trapianto di midollo autologo (quest’ultimo riservato ai pazienti giovani con linfoma mantellare in prima linea).
Nei LNH di tipo B ad andamento indolente il trattamento è riservato ai pazienti sintomatici per sintomi B o sintomi da compressione, in caso di compromissione della funzionalità d’organo dovuta alla compressione esercitata dalle masse, in presenza di interessamento di particolari sedi extranodali (ad esempio versamento pleurico/pericardico), di citopenia (ovvero in caso di anemia, leucopenia o piastrinopenia). In tal caso la terapia potrà consistere in programmi di immunoterapia (ovvero con Rituximab in moterapia), immuno-chemioterapia abbreviata (R-CHOP come sopra, R-Bendamustina o regimi contenenti Fludarabina) o nella sola radioterapia (in caso di malattia localizzata), oppure nella combinazione di immuno-chemioterapia e radioterapia sulle masse bulky (in caso di malattia sistemica). Recentemente inoltre si sta diffondendo l’utilizzo della radio-immunoterapia, effettuata con l’anticorpo anti-CD20 coniugato a radionuclidi.
In assenza dei criteri per iniziare il trattamento l’approccio utilizzato consiste nel cosiddetto “watchful waiting”, ovvero il follow up periodico in attesa dell’eventuale progressione di malattia. Esiste una forma particolare di linfoma, il linfoma della zona marginale dello stomaco, che si associa all’infezione da Helicobacter pylori e che, nelle fasi iniziali di malattia, può regredire grazie alla terapia eradicante del batterio.
I pazienti giovani che non ottengono la remissione con la terapia di prima linea o che manifestano una recidiva dopo il raggiungimento della remissione possono giovare di una chemioterapia di salvataggio con raccolta delle cellule staminali e successivo trapianto autologo. Per i pazienti che presentano una ricaduta di malattia dopo trapianto autologo di cellule staminali ematopoietiche un’alternativa è rappresentata dal trapianto allogenico (da donatore familiare o da registro). Nel caso di pazienti anziani che, pertanto, non sono candidati alla procedura trapiantologica, possono essere utilizzati programmi di polichemioterapia di salvataggio.
Attualmente sono in corso numerosi studi (in Italia e all’estero) che stanno testando l’utilizzo di nuovi anticorpi anti-CD20 e altri nuovi farmaci, da soli o in associazione a protocolli standard di terapia, sia in prima linea che nei casi refrattari o in recidiva.
Nei LNH di tipo T (gruppo eterogeneo di linfomi a prognosi sfavorevole che rappresenta complessivamente il 10% di tutti i linfomi) l’approccio terapeutico prevede l’utilizzo dello schema CHOP, seguito dall’intensificazione del trattamento con terapia ad alte dosi e trapianto di midollo autologo. Altri farmaci utilizzati che sono risultati promettenti negli studi clinici per questo tipo di linfomi sono la Gemcitabina, l’Alentuzumab (l’anticorpo monoclonale anti-CD52), il Pralatraxate (un anti-folato), la Romidepsina (un inibitore delle iston-deacetilasi) ed il Brentuximab vedotin (un anticorpo anti-CD30 coniugato ad una tossina).
Studi in corso
Presso il nostro Centro sono attivi o in via di attivazione i seguenti studi multicentrici:
- Linfomi aggressivi:
- Studio R-BENDA500: “Studio di Fase II R‐BAC (Rituximab, Bendamustina, Citarabina) come terapia di induzione nei pazienti anziani affetti da Linfoma Mantellare”. Sponsor: Fondazione Italiana Linfomi (FIL).
- Studio R2-B: “Studio di fase II sull’uso combinato di Bendamustina, Lenalidomide e Rituximab (R2-B) come seconda linea di terapia nei pazienti affetti da linfoma mantellare refrattari o in prima recidiva”. Sponsor: FIL.
- Studio R-BENDA FRAIL: “Rituximab in combinazione con Bendamustina nel trattamento di prima linea di pazienti anziani (> 70 anni) fragili affetti da linfoma diffuse a grandi cellule B: studio di fase II della Fondazione Italiana Linfomi (FIL)”. Sponsor: FIL.
- Studio SCNSL1: “High-Dose Sequential Chemoimmunotherapy for B-Cell Lymphomas With Central Nervous System Involvement”. Sponsor: Intergruppo Italiano Linfomi (IIL).
- Linfomi indolenti:
- Studio BO21223: “A multicenter, phase III, open-label, randomized study in previously untreated patients with advanced indolent non Hodgkin lymphoma evaluating the benefit of GA101 (RO5072759) plus chemotherapy compared with Rituximab plus chemotherapy followed by GA101 or rituximab maintenance therapy in responders”. Sponsor: Roche.
- Studio MO25455: “A study comparing maintenance subcutaneous rituximab with observation only in patients with relapsed or refractory indolent non-Hodgkin’s lymphoma who had responded to Rituximab-based immunochemotherapy induction and two years of maintenance with subcutaneous Rituximab”. Sponsor: Roche.
- Studio BO21223: “A multicenter, phase III, open-label, randomized study in previously untreated patients with advanced indolent non Hodgkin lymphoma evaluating the benefit of GA101 (RO5072759) plus chemotherapy compared with Rituximab plus chemotherapy followed by GA101 or rituximab maintenance therapy in responders”. Sponsor: Roche.

